Realizar una tinción de superficie e intracelular de células linfoides para su posterior análisis por citometría de flujo
Este procedimiento involucra a todo el personal técnico, científico y estudiantes que deseen Realizar una tinción de superficie e intracelular de células linfoides para su posterior análisis por citometría de flujo en la Unidad de Investigación Epidemiológica en Endocrinología y Nutrición del Instituto Nacional de Salud Hospital Infantil de México Federico Gómez.
Es responsabilidad de todo el personal científico, estudiantes y técnicos adscritos a la Unidad de Investigación Epidemiológica en Endocrinología y Nutrición del Hospital Infantil de México Federico Gómez conocer y dar seguimiento a este procedimiento. Los residuos de tipo CRETI (Corrosivas, Reactivas, Explosivas, Toxicas e Inflamables) se deberán eliminar con base en su clasificación y especificaciones de manejo según la Norma Oficial Mexicana NOM-087-ECOL-SSA1-2002; así como sus características intrínsecas y su toxicidad al ambiente según la NOM-052- SEMARNAT-2005
Descripción del Protocolo
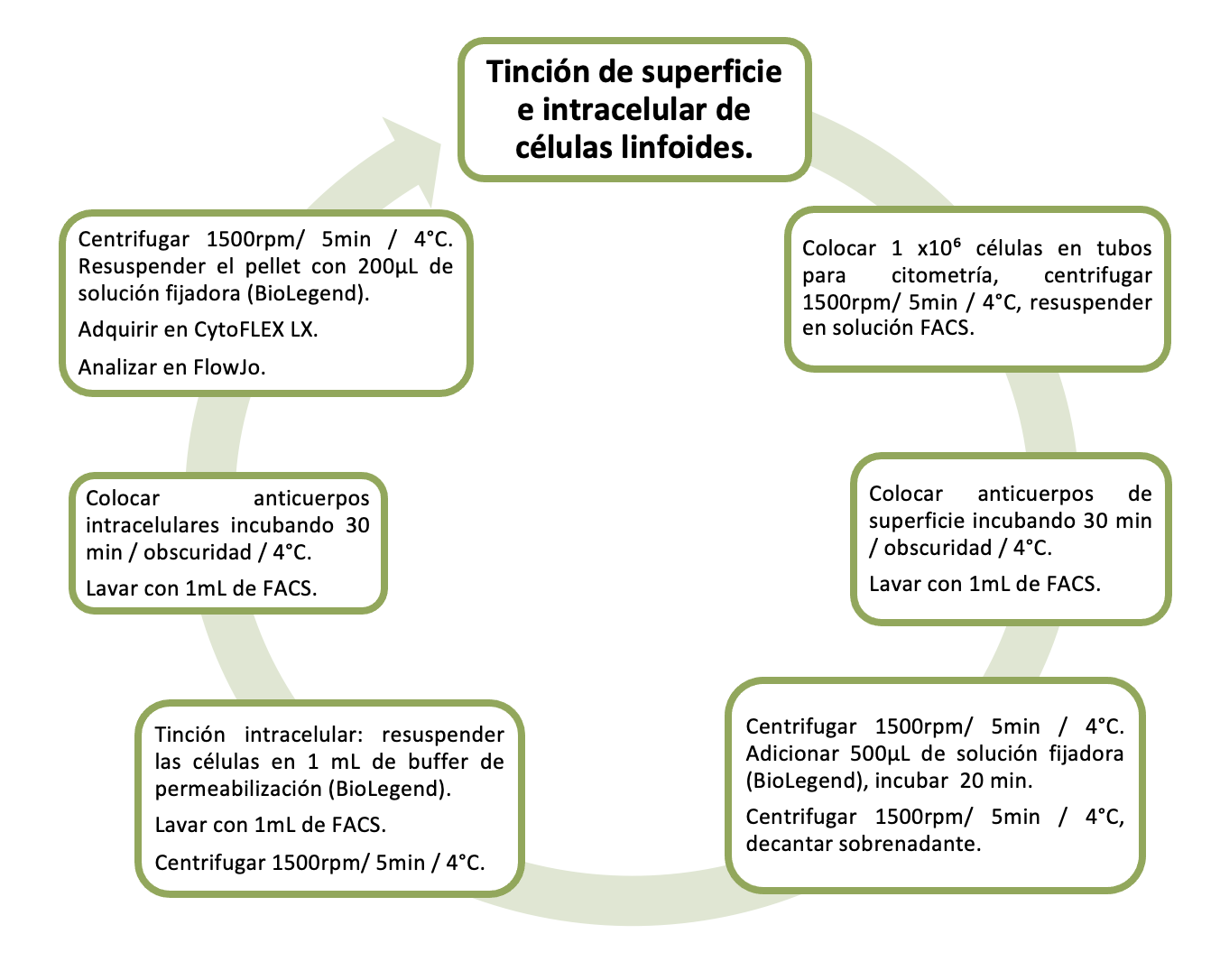
Tinción de superficie Colocar 1 x10⁶ células en tubos para citometría de flujo. Centrifugar a 1500rpm / 5 minutos / 4°C. Re-suspender en 200µL de solución FACS (PBS 1X y SFB 2%). Colocar anticuerpos de superficie titulados, incubar 30 minutos / obscuridad / 4ºC. Lavar con 1mL de solución FACS.
Centrifugar a 1500 rpm / 5 minutos / 4°C. Adicionar 500 µL de solución fijadora (BioLegend) o en su defecto, 100 µL de paraformaldehído 4%. Incubar 20 minutos / obscuridad / 4ºC. Lavar con 1mL de solución FACS. Centrifugar 1500rpm / 5 minutos / 4°C. Decantar el sobrenadante y re-suspender las células en 200µl de solución FACS. Analizar la muestra inmediatamente o en los 2 días posteriores a la tinción. Conservar la muestra hasta realizar el análisis.
Tinción intracelular Realizar tinción de superficie. Re-suspender las células en 1mL de buffer de permeabilización (BioLegend). Incubar 5 minutos / 4ºC. Lavar con 1mL de buffer de permeabilización (BioLegend). Centrifugar 1500rpm / 5 minutos / 4°C. Colocar anticuerpos intracelulares titulados. Incubar 30 minutos / obscuridad / 4ºC. Lavar con 1mL de buffer de permeabilización (BioLegend). Centrifugar 1500rpm / 5 minutos / 4°C. Re-suspender el pellet en 200µL de solución FACS. Analizar la muestra inmediatamente o en los 2 días posteriores a la tinción. Conservar la muestra hasta realizar el análisis.
Diagrama de Flujo
Anexos
Reactivos y Soluciones
- Reactivos
- UltraPure Agarose de Invitrogen
- SYBR SAFE
- Buffer carga 6X DNA Loading Dye
- Marcador de peso molecular
- TAE 1X
- TAE
| 1X | 50X | |
|---|---|---|
| Tris | 40 mM | 242 g |
| Ácido Acético | 20 mM | 57.1 mL |
| Na2EDTA-2H2O | 1 mM | 18.61 g |
| dH2O1 | 1 L | 1 L |
Documentos de referencia
Bushnell, T. Modern Flow Cytometry. 1–67 (Excyte, 2015).
Notas
aforar a↩︎